Thi thử bài tập trắc nghiệm ôn tập môn Hoá đại cương online - Đề #8
Câu 1:
Xét hệ cân bằng gồm ba chất có mặt trong phản ứng sau: NH4Cl(r) ⇌ HCl(k) + NH3(k).
(1) Hệ có số cấu tử là 3, số pha là 2, số bậc tự do là 2.
(2) Hệ có số cấu tử là 2, số pha là 2, số bậc tự do là 2.
(3) Nếu nồng độ HCl và NH3 bằng nhau thì số cấu tử của hệ là 1, số pha là 2, số bậc tự do là 1.
(4) Nếu nồng độ HCl và NH3 bằng nhau thì số cấu tử của hệ là 2, số pha là 2, số bậc tự do là 2.
Câu 2:
Chọn phương án đúng: Đối với một hệ hơi nước: (1) Có thể thay đổi cả nhiệt độ và áp suất của hệ trong phạm vi cho phép để hệ vẫn ở trạng thái hơi. (2) Phải giữ nhiệt độ của hệ trên 100°C để hệ vẫn ở trạng thái hơi. (3) Nếu nhiệt độ của hệ bị hạ xuống dưới 100°C, hệ sẽ chuyển sang trạng thái lỏng.
Câu 3:
Trong giản đồ sau, đường biểu diễn cân bằng Rắn ⇌ Khí là:
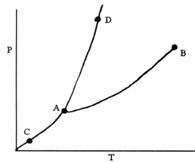
Câu 4:
Chọn phát biểu đúng: Đối với phản ứng một chiều, tốc độ phản ứng sẽ:
Câu 5:
Chọn câu sai. Hằng số tốc độ phản ứng:
Câu 6:
Chọn câu sai: Hằng số tốc độ của phản ứng nA + mB = AnBm
Câu 7:
Chọn đáp án đúng: Cho phản ứng: 2A(k) + B(k) ® C(k).Biểu thức tốc độ phản ứng phải là:
Câu 8:
Phản ứng phân hủy oxit dinitơ có sơ đồ tổng quát: 2N2O(k) ® 2N2(k) + O2(k), với v = k[N2O]. Người ta cho rằng phản ứng trải qua hai bước sơ cấp: Bước 1: N2O ® N2 + O. Bước 2: N2O + O ® N2 + O2. Vậy, phát biểu nào dưới đây phù hợp với các dữ liệu trên:
Câu 9:
Chọn ý sai: Cho phản ứng aA + bB = cC + dD có $v = kC_A^mC_B^n$. Bậc của phản ứng: (1) Luôn bằng (n + m) ; (2) Ít khi lớn hơn 3 ; (3) Bằng (c+d) – (a+b) ; (4) Có thể là phân số ; (5) Bằng (a + b).
Câu 10:
Cho phản ứng: 2H2 (k) + O2 (k) ® 2H2O (k). Tốc độ trung bình của phản ứng được xác định theo [O2] là $\overline v = \frac{{ - \Delta \left[ {{O_2}} \right]}}{{\Delta \tau }}$. Chọn biểu thức đúng của $\overline v$ nếu biểu diễn theo [H2O].
Câu 11:
Đại lượng nào sau đây của phản ứng sẽ thay đổi khi được thêm xúc tác:
Câu 12:
Chọn đáp án đúng: Một phản ứng có năng lượng hoạt hóa là 4,82 × 102 cal/mol. Nếu ở 275K phản ứng có hằng số tốc độ là 8,82 × 10-5, thì ở 567K hằng số tốc độ là:
Câu 13:
Chọn đáp án đúng: Một phản ứng bậc nhất có chu kỳ bán hủy là 45 phút 30 giây. Xác định hằng số tốc độ của phản ứng trên.
Câu 14:
Chọn phương án đúng: Phản ứng 2A + 2B + C ® D + E có các đặc điểm sau:
* [A], [B] không đổi, [C] tăng gấp đôi, vận tốc v không đổi.
* [A], [C] không đổi, [B] tăng gấp đôi, vận tốc v tăng gấp đôi.
* [A], [B] đều tăng gấp đôi, vận tốc V tăng gấp 8 lần.
Cả ba thí nghiệm đều ở cùng một nhiệt độ. Biểu thức của vận tốc v theo các nồng độ A, B, C là:
Câu 15:
Chọn phương án đúng: Một phản ứng A + 2B = C bậc 1 đối với [A] và bậc 1 đối với [B], được thực hiện ở nhiệt độ không đổi.
Câu 16:
Chọn phương án đúng: Phản ứng CO(k) + Cl2(k) ® COCl2(k) là phản ứng đơn giản. Nếu nồng độ CO tăng từ 0,1M lên 0,4M; nồng độ Cl2 tăng từ 0,3M lên 0,9M thì tốc độ phản ứng thay đổi như thế nào?
Câu 17:
Chọn phương án đúng: Trong các phương trình sau đây, phương trình nào chắc chắn không thể biểu thị cho một tác dụng cơ bản (phản ứng sơ cấp)?
1) N2 + 3H2 ® 2NH3
2) $\frac{1}{2}{N_2} + \frac{3}{2}{H_2} \to N{H_3}$
3) 8NO + 4O2 ® 8NO2
4) ${H_2} + \frac{1}{2}{O_2} \to {H_2}O$
Câu 18:
Chọn đáp án đúng: Đối với phản ứng: 4NH3 + 3O2 ® 2N2 + 6H2O. Tốc độ tạo ra N2 là 0,270 mol/lít.s. Ta có: (1) Tốc độ tạo thành H2O là 0,540 mol/lít.s. (2) Tốc độ mất đi của NH3 là 0,810 mol/lít.s. (3) Tốc độ mất đi của O2 là 0,405 mol/lít.s. (4) Tốc độ của phản ứng là 0,135 mol/lít.s.
Câu 19:
Chọn phát biểu đúng: Tốc độ phản ứng đồng thể khí tăng khi tăng nồng độ là do:
Câu 20:
Chọn phát biểu đúng: Sự tăng nhiệt độ có tác động đến một phản ứng thuận nghịch:
Câu 21:
Khi tăng nhiệt độ, tốc độ phản ứng tăng vì sự tăng nhiệt độ đó:
Câu 22:
Chọn phát biểu đúng: Chất xúc tác có ảnh hưởng như thế nào đến trạng thái cân bằng của phản ứng tỏa nhiệt?
Câu 23:
Chọn đáp án đúng: Khi có mặt chất xúc tác, DH° của phản ứng:
Câu 24:
Chọn các đặc tính đúng của chất xúc tác. Chất xúc tác làm cho tốc độ phản ứng tăng lên nhờ các đặc tính sau: (1) Làm cho DG của phản ứng âm hơn. (2) Làm tăng vận tốc phản ứng nhờ làm giảm năng lượng hoạt hóa của phản ứng. (3) Làm tăng vận tốc của phản ứng nhờ làm tăng vận tốc chuyển động của các tiểu phân. (4) Làm cho DG của phản ứng đổi dấu từ dương sang âm.
Câu 25:
Chọn câu sai trong các câu sau. Chất xúc tác:
Câu 26:
Chọn ý sai: Tốc độ phản ứng càng lớn khi:
Câu 27:
Chọn câu đúng: Tốc độ của phản ứng dị thể:
Câu 28:
Chọn câu đúng. Tốc độ của phản ứng hòa tan kim loại rắn trong dung dịch acid sẽ: (1) Giảm xuống khi giảm nhiệt độ phản ứng. (2) Tăng lên khi tăng kích thước các hạt kim loại. (3) Giảm xuống khi giảm áp suất phản ứng. (4) Tăng lên khi tăng nồng độ acid.
Câu 29:
Chọn đáp án đúng và đầy đủ nhất: Có một số phản ứng tuy có DG < 0 song trong thực tế phản ứng vẫn không xảy ra. Vậy có thể áp dụng những biện pháp nào trong các cách sau để phản ứng xảy ra: (1) Dùng xúc tác ; (2) Thay đổi nhiệt độ ; (3) Tăng nồng độ tác chất ; (4) Nghiền nhỏ các tác chất rắn.
Câu 30:
Chọn phương án đúng: Phản ứng N2(k) + O2(k) ® 2NO(k) tỏa nhiệt. Tốc độ của phản ứng này sẽ tăng lên khi áp dụng các biện pháp sau: (1) Dùng xúc tác ; (2) Nén hệ; (3) Tăng nhiệt độ ; (4) Giảm áp suất hệ phản ứng.
Câu 31:
Chọn đáp án đúng: Một phản ứng kết thúc sau 3 giờ ở 20°C. Ở nhiệt độ nào phản ứng sẽ kết thúc sau 20 phút, biết hệ số nhiệt độ của phản ứng là 3.
Câu 32:
Chọn đáp án đúng: Phản ứng thuận nghịch A2 (k) + B2 (k) ⇄ 2AB (k). Có hệ số nhiệt độ g của phản ứng thuận và phản ứng nghịch lần lượt là 2 và 3. Hỏi khi tăng nhiệt độ cân bằng dịch chuyển theo chiều nào và từ đó suy ra dấu của DH° của phản ứng thuận.
Câu 33:
Chọn đáp án đúng: Quá trình phân hủy phóng xạ Radi: ${}_{88}^{226}Ra \to {}_{86}^{222}Ra + {}_2^4He$ được xem là phản ứng bậc nhất, đơn giản. Hãy xác định thời gian để 3g Radi giảm xuống còn 0,375g. Biết thời gian bán phân hủy của Radi là 1260 năm.
Câu 34:
Chọn đáp án đúng: Đương lượng của HNO3 (Phân tử lượng M) bằng:
Câu 35:
Cho phản ứng: Al2(SO4)3 + 4NaOH = 2Na2SO4 + [Al(OH)2]2SO4. Đương lượng gam của Al2(SO4)3 và NaOH lần lượt bằng: (Cho biết phân tử gam của Al2(SO4)3 bằng 342g và của NaOH bằng 40g)
Câu 36:
Chọn đáp án đúng: Cho phản ứng: 2KAl(SO4)2.12H2O + 4NaOH = 2Na2SO4 + [Al(OH)2]2SO4 + K2SO4 + 24H2O. Đương lượng gam của KAl(SO4)2.24H2O và NaOH lần lượt bằng: (Cho biết phân tử gam của KAl(SO4)2.12H2O bằng 474g và của NaOH bằng 40g)
Câu 37:
Chọn đáp án đúng: Cho phản ứng: MnO2 + 4HClđặc, nóng = MnCl2 + Cl2 + 2H2O. Đương lượng gam của MnO2 và HCl lần lượt bằng: (cho biết phân tử gam của MnO2 bằng 87g và của HCl bằng 36,5g)
Câu 38:
Tính nồng độ mol của KMnO4 trong phản ứng với acid citric trong môi trường H+, biết ${C_{NKMn{O_4}}} = 0.1N$. 2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O.
Câu 39:
Chọn đáp án đúng: Tính thể tích dung dịch HCl 4M cần thiết để có thể pha thành 1 lít dung dịch HCl 0,5M.
Câu 40:
Chọn phát biểu đúng: (1) Chỉ tồn tại các dung dịch ở thể lỏng và thể khí. (2) Các dung dịch là những hệ phân tán và tất cả các hệ phân tán đều là dung dịch. (3) Dung dịch phân tử - ion là những dung dịch thực. (4) Dung dịch là những hệ phân tán mà trong đó các hạt phân tán có kích thước cỡ phân tử hay ion. (5) Không khí được xem là dung dịch.
Câu 41:
Chọn một phát biểu đúng trong các phát biểu dưới đây:
Câu 42:
Chọn phát biểu đúng: (1) Dung dịch là những hệ đồng thể gồm hai hay nhiều chất mà thành phần của chúng thay đổi trong giới hạn rộng. (2) Trong dung dịch dung môi là chất có lượng nhiều hơn và là môi trường phân tán. (3) Hằng số điện môi là đại lượng quan trọng trong việc lựa chọn dung môi, hằng số điện môi phụ thuộc vào độ có cực, cấu tạo và kích thước phân tử dung môi.
Câu 43:
Chọn phát biểu đúng về dung dịch rắn:
Câu 44:
Chọn phát biểu đúng: (1) Nồng độ dung dịch đồng nhất trong toàn bộ dung dịch được giải thích bằng sự khuyếch tán các tiểu phân chất tan vào trong dung môi. (2) Bản chất của lực tương tác giữa các tiểu phân chất tan và dung môi là các tương tác vật lý. (3) Trong quá trình tạo thành dung dịch, các quá trình vật lý bao gồm sự phá vỡ mạng tinh thể, sự khuyếch tan chất tan vào dung môi được gọi chung là sự chuyển pha. (4) Sự tương tác giữa dung môi và các tiểu phân chất tan là yếu tố quan trọng hàng đầu quyết định sự tạo thành dung dịch.
Câu 45:
Chọn phát biểu đúng trong các ý sau: