Thi thử bài tập trắc nghiệm ôn tập môn Hoá đại cương online - Đề #18
Câu 1:
Chọn câu đúng. Đối với dung dịch loãng của chất tan không điện ly, không bay hơi:
Câu 2:
Chọn phương án đúng: Ở 25°C, áp suất hơi bão hòa của nước nguyên chất là 23,76mmHg. Khi hòa tan 2,7mol glyxerin vào 100mol H2O ở nhiệt độ trên thì độ giảm tương đối áp suất hơi bão hòa của dung dịch so với nước nguyên chất bằng:
Câu 3:
Chọn phương án đúng: Cho các số liệu sau: (1) jo (Al3+/Al) = - 1,706 V ; (2) jo (Zn2+/Zn) = - 0,764 V ; (3) jo (Cu2+/Cu+) = + 0,15 V ; (4) jo (Cu+/Cu) = + 0,522 V. Các chất được sắp xếp theo thứ tự tính oxy hóa tăng dần như sau:
Câu 4:
Trước đây, người ta không không rõ ion thủy ngân (I) tồn tại trong dung dịch dưới dạng $Hg_n^{n + }$ với giá trị n bằng bao nhiêu. Để xác định n, có thể lập một pin như sau ở 25oC. Pt, Hg(ℓ)| dd A|| dd B| Hg(ℓ), Pt. 1 lít dung dịch A chứa 0,263g Hg(I) nitrat và 1 lit dung dịch B chứa 2,630g Hg(I) nitrat. Sức điện động đo được là 0,0289 V. Hãy xác định giá trị của n.
Câu 5:
Chọn phát biểu đúng: Phản ứng A (k) ⇄ B (k) + C (k) ở 300oC có Kp = 11,5; ở 500oC có Kp = 23. Tính ∆Ho của phản ứng trên. Cho R = 8,314 J/mol.K.
Câu 6:
Chọn phương án đúng: Biết tích số tan ở 25oC của Al(OH)3 là 1×10-32. Dung dịch AlCl3 0,1M sẽ xuất hiện kết tủa khi có độ pH của dung dịch:
Câu 7:
Theo định nghĩa của nhiệt tạo thành, trong các phản ứng sau, phản ứng nào được xem là phản ứng tạo thành ở 298K. (1) N (k) + 2O (k) = NO2 (k) ; (2) ½ N2 (k) + ½ O2 (k) = NO (k) ; (3) CaO (r) + CO2 (k) = CaCO3 (r) ; 4) Na (ℓ) + ½ Cl2 (k) = NaCl (r) ; (5) ½ H2 (k) + ½ I2 (r) = HI (k).
Câu 8:
Chọn phương án đúng: Trộn các dung dịch:
1) 100ml dung dịch AgNO3 2×10–4M với 50ml dung dịch K2CrO4 6×10–3M
2) 100ml dung dịch AgNO3 2×10–4M với 50ml dung dịch K2CrO4 6×10–4M
3) 100ml dung dịch AgNO3 2×10–4M với 50ml dung dịch K2CrO4 6×10–5M
Trong trường hợp nào có sự tạo thành kết tủa Ag2CrO4? Cho biết tích số tan của Ag2CrO4 là T = 2 × 10–12.
Câu 9:
Chọn phát biểu đúng. Thiết lập biểu thức ∆G của phản ứng sau ở 25oC. 2 Hg (ℓ) + O2 (k) ⇄ 2HgO (tinh thể):
Câu 10:
Chọn hệ số tỉ lượng đúng. Cân bằng phương trình phản ứng dưới đây: NaClO3 + MnO2 + NaOH ® Na2MnO4 + NaCl + H2O. Nếu hệ số trước NaClO3 là 1 thì hệ số đứng trước MnO2 và NaOH lần lượt là:
Câu 11:
Chọn phương án đúng: Cho cân bằng CO2(k) + H2(k) ⇄ CO(k) + H2O(k). Tính hằng số cân bằng Kc của phản ứng. Biết rằng phản ứng được thực hiện trong bình kín có dung tích 1 lít chứa 0,3 mol CO2 và 0,3 mol H2 lúc ban đầu. Khi phản ứng cân bằng ta có 0,2 mol CO tạo thành. Nếu nén hệ cho thể tích của hệ giảm xuống, cân bằng sẽ chuyển dịch như thế nào?
Câu 12:
Một bình đoạn nhiệt được tách thành hai ngăn dung tích bằng nhau: ngăn thứ nhất chứa 2,0 mol hydro ở 3,0 atm và 25oC; ngăn thứ hai chứa 3,0 mol argon ở 4,5 atm và 25oC. Hai khí được coi là lý tưởng. Người ta nhấc vách ngăn ra, hai khí trộn lẫn vào nhau, không phản ứng. Hãy tính ∆G của hỗn hợp. Cho R = 8,314 J/mol.K.
Câu 13:
Tính công dãn nở khi cho 10mol CH3CHOHCH3 vào bình chân không, phân ly ở 177oC theo phản ứng sau: CH3CHOHCH3 (k) ⇄ CH3COCH3 (k) + H2 (k). Cho biết R = 8,314 J/mol.K, xem các khí trong phản ứng là khí lý tưởng.
Câu 14:
Chọn phương án đúng: Cho phản ứng: C6H6 + \frac{{15}}{2} O2(k) ® 6CO2(k) + 3H2O. Ở 270C phản ứng có ∆H – ∆U = 3741,3 J. Hỏi C6H6 và H2O trong phản ứng ở trạng thái lỏng hay khí? Cho biết R = 8,314 J/mol.K.
Câu 15:
Chọn phương án đúng. Cho quá trình điện cực: 3Fe3+(dd) + 4H2O(ℓ) + 1e → Fe3O4(r) + 8H+(dd). Phương trình Nerst đối với quá trình đã cho ở 250C có dạng:
Câu 16:
Hãy xác định ở giá trị nào của pH thì phản ứng sau bắt đầu xảy ra theo chiều thuận ở 25oC. HAsO2(dd) + I2(r) + 2H2O(ℓ) ⇄ H3AsO4(dd) + 2I- (dd) + 2H+ (dd). Cho biết, ở 25oC: \varphi _{\left( {{H_3}As{O_4}/HAs{O_2}} \right)}^0 = + 0,559V ; \varphi _{\left( {{I_2}/{I^ - }} \right)}^0 = + 0,5355V. Nồng độ các chất: [H3AsO4]=[I-]=[HAsO2] = 1M
Câu 17:
Chọn phương án đúng: Trong 200g dung môi chứa A g đường glucô có khối lượng phân tử M; hằng số nghiệm đông của dung môi là Kđ. Hỏi biểu thức nào đúng đối với DTđ:
Câu 18:
Tính hằng số cân bằng K ở 25oC của phản ứng sau: 3ZnS(r) + 2NO3-(dd) + 8H+(dd) ⇄ 3Zn2+(dd) + 2NO(k) + 4H2O(ℓ) + 3S(r). Cho biết ở 25oC:
Tích số tan của ZnS là TZnS = 2×10-24
Hằng số điện ly của H2S là Ka1 . Ka2 = 3×10-20
Phản ứng: 3H2S(dd) + 2NO3-(dd) + 2H+(dd) ⇄ 2NO(k) + 4H2O(ℓ) + 3S(r) có hằng số cân bằng K = 1083.
Câu 19:
Chọn phương án đúng: Cho giản đồ hòa tan như hình sau:
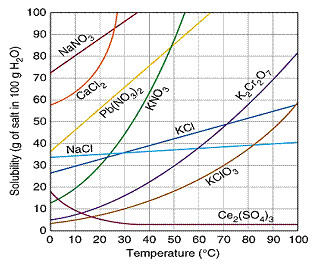
Hòa tan hoàn toàn 10g KClO3 vào 100g nước ở 40°C, giả sử nước không bị hóa hơi ở nhiệt độ này. Sau đó dung dịch được đưa về nhiệt độ 30°C và không có kết tủa xuất hiện. Vậy trạng thái dung dịch thu được ở 30°C đó là:
Câu 20:
Chọn phát biểu sai: Xét phản ứng đốt cháy metan ở điều kiện đẳng áp, đẳng nhiệt ở 25oC: CH4(k) + 2O2(k) = CO2(k) + 2H2O(k), ∆Ho298, pư = –758,23 kJ/mol. (Coi các khí trong phản ứng là khí lý tưởng)
1) Nhiệt phản ứng chuẩn đẳng tích ở 25oC của phản ứng trên là – 758,23 kJ.
2) Phản ứng trên không sinh công dãn nở.
3) Độ biến thiên entropy chuẩn của phản ứng ở 25oC gần bằng 0.
4) Ở 25oC, hằng số cân bằng KP > KC.
Câu 21:
Chọn phương án đúng: Nhỏ từng giọt dung dịch (NH4)2C2O4 0,01M vào 1 lít dung dịch chứa 1 ion gam Ba2+ và 0,005 ion gam Ca2+ . Hỏi kết tủa nào xuất hiện trước? (Cho tích số tan của BaC2O4 và CaC2O4 lần lượt bằng 10-6,96 và 10-8,64).
Câu 22:
Tính hằng số cân bằng KC ở 25oC của phản ứng sau: CuCl (r) + I- (dd) ⇄ CuI (r) + Cl- (r). Biết tại nhiệt độ này: TCuCl = 1,9 ×10-7; TCuI = 5,1 ×10-12.
Câu 23:
Hãy cho biết dạng $\delta - Mn$ (tinh thể) và dạng $\beta - Mn$ (tinh thể), dạng nào bền hơn ở điều kiện chuẩn, 25oC. Biết phản ứng: $\delta - Mn$ (tinh thể) ® $\beta - Mn$ (tinh thể), có ∆Ho298 = 1,55 ×103 J/mol và ∆So298 = 0,545 J/mol.
Câu 24:
So sánh áp suất thẩm thấu của các dung dịch sau: CH3COOH (1), C6H12O6 (2), NaCl (3), CaCl2 (4) cùng có nồng độ 0,01M và ở cùng một nhiệt độ (xem các muối NaCl và CaCl2 điện ly hoàn toàn).
Câu 25:
Chọn phát biểu chính xác: (1) Độ điện ly (a) tăng khi nồng độ của chất điện li tăng. (2) Độ điện ly (a) không thể lớn hơn 1. (3) Trong đa số trường hợp, độ điện ly tăng lên khi nhiệt độ tăng. (4) Chất điện ly yếu là chất có a < 0,03.
Câu 26:
Chọn phương án đúng: Cho phản ứng: H3PO4 + 2NaOH = Na2HPO4 + 2H2O. Đương lượng gam của H3PO4 và NaOH lần lượt bằng: (Cho biết phân tử gam của H3PO4 bằng 98g và của NaOH bằng 40g)
Câu 27:
Chọn phương án đúng: Cho một phản ứng thuận nghịch trong dung dịch lỏng: A + B ⇄ 2C + D. Hằng số cân bằng Kc ở điều kiện cho trước bằng 50. Một hỗn hợp có nồng độ CA = CB = 10-3M, CC = CD = 0,01M. Trạng thái của hệ ở điều kiện này như sau:
Câu 28:
Chọn phương án đúng: (1) Các acid và base không thể cùng tồn tại trong một dung dịch. (2) Phản ứng trao đổi ion xảy ra khi tạo thành chất ít điện ly, chất ít tan hoặc chất bay hơi. (3) Hiệu ứng nhiệt của phản ứng trung hòa giữa acid mạnh và base yếu chỉ phụ thuộc bản chất của base. (4) Phản ứng trao đổi ion thường xảy ra với tốc độ lớn.
Câu 29:
Chọn phương án đúng: 1 lít dung dịch nước chứa 2g chất tan không điện ly, không bay hơi có áp suất thẩm thấu p = 0,2 atm ở 25°C. Hãy tính khối lượng mol của chất đó (cho R = 0,082 lít.atm/mol.K = 8,314 J/mol.K = 1,987 cal/mol.K)
Câu 30:
Chọn trường hợp đúng: Cho biết tích số tan của AgCl ở 250C là 10–10. (1) Độ tan của AgCl trong nước nguyên chất là 10–5 mol/l. (2) Độ tan của AgCl trong dung dịch KCl 0,1M giảm đi 107 lần so với trong nước nguyên chất. (3) Độ tan của AgCl trong nước sẽ ít hơn trong dung dịch KI 0,1M. (4) Độ tan của AgCl trong dung môi benzen sẽ lớn hơn trong dung môi nước.
Câu 31:
Chọn phương án đúng: Trong phản ứng: 3Cl2 +KI + 6KOH = 6KCl + KIO3 + 3H2O. KOH đóng vai trò:
Câu 32:
Chọn phương án đúng: Dựa vào ái lực proton của các dung môi NH3 và HClO4 cho biết CH3COOH thể hiện tính chất gì trong dung môi đó:
Câu 33:
Chọn phương án đúng: Phản ứng 2HI(k) ⇄ H2(k) + I2(k) có hằng số cân bằng KP = 9. Ở cùng nhiệt độ, phản ứng sẽ diễn ra theo chiều nào khi áp suất riêng phần của H2, I2 và HI lần lượt là 0,2; 0,45 và 0,1 atm.
Câu 34:
Chọn phương án đúng: Trộn các dung dịch: (1) 100ml dung dịch AgNO3 10-4M với 100ml dung dịch HCl 10-5M. (2) 100ml dung dịch AgNO3 10-4M với 100ml dung dịch NaCl 10-4M. (3) 100ml dung dịch AgNO3 10-4M với 100ml dung dịch HCl 10-6 M. Trong trường hợp nào có sự tạo thành kết tủa AgCl? Cho tích số tan của AgCl là T = 10 -9,6.
Câu 35:
Chọn phương án đúng: Xác định pH của dung dịch acid acetic sau khi đã phản ứng với một nửa lượng NaOH cần thiết để trung hòa hoàn toàn. Cho biết pKa của acid acetic bằng 4,76.
Câu 36:
Chọn phương án đúng: Cho phản ứng oxy hóa khử: HI + H2SO4 = I2 + S + H2O. Cân bằng phản ứng trên. Nếu hệ số trước H2SO4 là 1 thì hệ số đứng trước HI và I2 lần lượt là:
Câu 37:
Chọn trường hợp đúng. Biết rằng nhiệt tạo thành tiêu chuẩn của AsH3 (k), NH3(k), PH3 (k) và C2H4 (k) lần lượt bằng: 66,44 ; -46,11; 5,4 ; 52,26 (kJ/mol). Trong 4 chất này, chất dễ bị phân hủy thành đơn chất nhất là:
Câu 38:
Chọn câu trả lời đúng. Hiệu ứng nhiệt đẳng áp của mỗi phản ứng hóa học:
Câu 39:
Chọn phương án đúng: pH của dung dịch nào sẽ hầu như không thay đổi khi pha loãng 2 lần bằng nước: (1) NH4NO2 0,2N ; (2) HClO3 0,1N và NaClO3 0,1N; (3) NH4Cl 0,1N và NH3 0,1N ; (4) NaNO2 0,1N và HNO2 0,1N.
Câu 40:
Chọn phương án đúng và đầy đủ: Cho pin điện hóa: $\left( 1 \right)Cr\left| {C{r_2}{{\left( {S{O_4}} \right)}_3}1M} \right|\left| {C{r_2}{{\left( {S{O_4}} \right)}_3}0.02M} \right|Cr\left( 2 \right)$. (1) Điện cực (1) gọi là cathode, có xuất hiện kết tủa Crom. (2) Điện cực (2) gọi là anod, điện cực Crom bị tan ra. (3) Suất điện động của pin là E = 0,0334V. (4) Trong quá trình pin hoạt động, nồng độ Cr3+(dd) ở điện cực (1) giảm dần và ở điện cực (2) tăng dần. Khi nồng độ Cr3+(dd) ở hai điện cực bằng nhau thì pin ngừng hoạt động.
Câu 41:
Chọn trường hợp đúng. Quá trình đông đặc nước đá ở -1°C và 1 atm có:
Câu 42:
Chọn phương án đúng: Xét chiều của phản ứng ở 250C: Fe + Cd2+ = Fe2+ +Cd, Cho biết: E0 = j0(Cd2+/Cd) - j0(Fe2+/Fe) = 0,04V.
1) Khi [Fe2+] = 0,10M và [Cd2+] = 1,00M phản ứng diễn ra theo chiều thuận
2) Khi [Fe2+] = 0,10M và [Cd2+] = 1,00M phản ứng diễn ra theo chiều nghịch
3) Khi [Fe2+] = 1,00M và [Cd2+] = 0,01M ứng diễn ra theo chiều thuận
4) Khi [Fe2+] = 1,00M và [Cd2+] = 0,01M ứng diễn ra theo chiều nghịch
Câu 43:
Chọn phương án đúng: Xác định khoảng pH của dung dịch NaHCO3. Cho biết với acid H2CO3, K1 >> K2.
Câu 44:
Chọn phương án đúng: Trong đa số trường hợp độ điện ly a của chất điện ly:
Câu 45:
Chọn đáp án đúng: Một phản ứng kết thúc sau 160 phút ở 40°C. Ở nhiệt độ nào phản ứng sẽ kết thúc sau 20 phút, biết hệ số nhiệt độ của phản ứng là 2.